Teori Atom (Dalton, Thomson, Ruterfo
Teori Atom Dalton
Sekitar 2,5 abab yang lalu, filusuf dari Yunani yaitu Leukippus
berpendapat bahwa suatu materi akan tersusun atas butiran-butiran
kecil, pendapat ini kemudian dikembangkan oleh seorang muridnya yang
bernama Demokritus. Demokritus selenjutnya berpendapat bahwa
suatu materi tersusun oleh partikel-partikel kecil yang tidak dapat
dibagi lagi, selajutnya partikel-partikel yag kecil tersebut dinamakan
dengan atom.
Konsep
atom ini selanjutnya berkembang setelah terdapat perumusan tentang
Hukum Kekekalan Massa dan Hukum Perbandingan Tetap, yaitu pada abab 18
John Dalton mengungkapan teori tentang atom
Pada tahun 1804, John Dalton mengemukakan tentang eksitensi dari suatu atom. Ia berpendapat bahwa konsep atom menurut Demokritus
benar karena tidak bertentangan dengan hukum Hukum Kekekalan Massa dan
Hukum Perbandingan Tetap. Berdasarkan pada pemikiran tersebut ia
merumuskan teori atom, teori tersebut sebagai berikut :
1. Materi tersusun dari partikel-partikel kecil yang disebut dengan atom
2. Unsur adalah materi yang tersusun dari atom-atom yang sejenis dengan massa dan sifat yang sama
3. Unsur yang berbeda memiliki atom-atom dengan massa dan sifat yang berbeda pula.
4. Senyawa
adalah materi yang tersusun dari sekurang- kurangnya 2 jenis atom
dari unsur-unsur yang berbeda, dalam senyawa atom-atom tersebut
berikatan melalui ikatan antar atom.
5. Atom tdak dapat dimusnahkan. Reaksi kimia hanyalah terjadi penataan ulang dari atom-atom yang terlibat dalam reaksi tersebut.
Dalam
perkembangannya, tidak semua isi teori atam Dalton adalah benar,
karena atom ternyata masih dapat terbagi lagi menjadi partikel-partikel
yang lebih kecil yaitu partikel subatomik, seperti elektron, proton
dan neuton.
Selain
mengungkapkan tentang teori atom, Dalton juga memberikan gambaran
tentang model atom, model tersebut digambarkan sebagai berikut :
John Dalton (1766-1844) Model Atom Dalton
Gambar John Dalton dan model atom dari John Dalton
Teori Atom Thomson
Penemuan elektron atas penelitian yang dilakukan oleh William Crookes (1875) yang disempurnakan oleh J.J. Thomson dan R. Milikan, memberikan bukti bahwa ketidaksempurnaan model atom Dalton, hal ini karena massa elektron lebih kecil dibandingkan dengan atom
J.J. Thompson memperinci model atom Dalton. Dikemukakannya bahwa “Atom merupakan bola pejal yang bermuatan positif dan didalamnya tersebar muatan negatif elektron.
Cara yang mudah dan praktis untuk menggambarkan model ini adalah dengan menganggap elektron sebagai kismis di dalam roti proton, sehingga model ini diberi nama model roti kismis. Berikut ini gambar JJ Thomson dan Model Atomnya
Model Atom Rutherford
Pada
tahun 1910, Rutherford melakukan eksperimennya dengan melakukan
penembakan sinar alfa terhadap sasaran sebuah lempeng emas tipis. Sinar
alfa merupakan sinar yang berasal dari partikel yang dipancarkan oleh
zat radioaktif. Sinar ini merupakan partikel atom helium yang bermuatan
positif serta mampu menembus berbagai logam.Hasil eksperimen menunjukkan bahwa adanya partikel alfa yang terpantul pada penembakan lempeng tipis emas. Fakta ini tidak sesuai dengan model atom yang dikemukakan oleh J.J. Thomson dimana atom digambarkan bersifat homogen pada seluruh bagiannya (tidak mengindikasikan adanya bagian yang lebih padat pada atom).
Berikut ini eksperimen yang dilakukan oleh Rutherford :
Gambar. I.8 Eksperimen yang dilakukan Rutherford
Dari ekperimen tersebut dapat disimpulkan bahwa :
a. Sebagian besar partikel sinar alfa diteruskan, menunjukkan bahwa pada atom terdapat ruang kosong
b. Partikel sinar alfa yang mendekati inti atom dibelokkan , menunjukkan adanya gaya tolak inti terhadap lempeng tipis emas
c. Adanya sinar yang dipantulkan, menunjukkan bahwa dalam atom-atom emas terdapat bagian yang padat yang mampu memantulkan partikel alfa dan bagian atom yang padat tersebut mempunyai muatan positif (partikel alfa yang bermuatan positif akan ditolak oleh bagian atom yang bermuatan positif)
Dengan kesimpulan ini Rutherford memberikan gagasan untuk model atom yaitu :
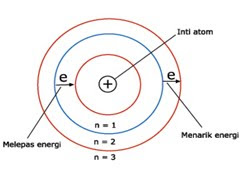
Atom tersusun atas inti atom yang memiliki muatan positif dan dikelilingi oleh elektron-elektron yang bermuatan negatif, hal ini dapat diasumsikan dengan planet yang mengelilingi matahari. Planet sebagi elektron sedangkan matahari adalah inti atom yang bermuatan positif. Berikut ini gambar model atomnya :
Pada tahun 1886, sebelum hakikat sinar katoda ditemukan, Goldstein melakukan
suatu eksperimen dengan tabung sinar katoda dan ia menemukan fakta
berikut: Yaitu apabila katoda tidak berlubang ternyata gas di belakang
katoda tetap gelap. Namun, apabila pada katoda berlubang ternyata gas
di belakang katoda menjadi berpijar. Hal ini menunjukkan bahwa adanya
radiasi yang berasal dari anoda, yang menerobos ke lubang dan menuju ke
katoda. Radiasi itu disebut dengan sinar anoda atau sinar positif atau
sinar terusan (yang ditunjukkan pada gambar dibawah ini)
Hasil
eksperimen ini menunjukkan bahwa sinar terusan merupakan radiasi
partikel (dapat memutar kincir) yang bermuatan positif (dalam medan
listrik dibelokkan ke kutub negatif). Partikel sinar terusan ternyata
bergantung pada jenis gas dalam tabung. Artinya, jika gas dalam tabung
diganti dengan gas yang lain, ternyata dihasilkan partikel sinar terusan
dengan ukuran yang berbeda. Partikel sinar terusan terkecil diperoleh
dari gas hidrogen.
Pada
tahun 1906, Ernesh Rutherford, ilmuwan yan berasal dari Inggris dengan
menggunakan alat spekrometer massa (modifikasi dari sinar katoda)
untuk membuktikan keberadaan dari partikel yang memliki muatan positif.
Dari penelitian yang telah dilakukan dihasilkan bahwa atom H
menghasilkan partikel bermuatan positif yang paling ringan. Massa
partikel positif dari atom-atom lainnya merupakan kelipatan dari massa
positif atomH.
Selanjutnya
pada tahun 1919, partikel positif dari atom H diberi nama yaitu proton
yang berasal dari bahasa Yunani yaitu “proteis” yang artinya yang
terpenting. Massa proton sekitar 1,672 x 10-27.
Eksperimen
Rutherford merupakan awal ditemukan neutron, dalam eksperimen yang ia
mencoba menghitung jumlah muatan positif dalam inti atom dan massa inti
atom, dengan harapan massa inti atom dan massa muatan positif sama
tetapi setelah dilakukan perhitungan ternyata massanya berbeda.
Ini dibuktikan oleh eksperimen yang dilakukan oleh Aston
pada ahun 1919 ia menemukan alat spektrometer massa, yaitu alat yang
dapat digunakan untuk menentukan massa atom dan massa molekul. Dengan
alat tersebut, Aston menemukan bahwa atom-atom dari unsur yang sama
dapat mempunyai massa yang berbeda. Fenomena ini selanjutnya disebut
dengan isotop, salah satu fenomena yang menggugurkan teori atom Dalton.
Selain itu juga ditemukan bahwa massa suatu atom ternyata tidak sama
dengan jumlah proton pada atom tersebut. Banyak atom yang massanya
sekitar dua kali massa protonnya. Berdasarkan kedua fakta tersebut,
Aston menduga keberadaan partikel netral dalam atom yang jumlahnya dapat
berbeda meskipun unsurnya sama.
Selain
itu lmuwan Amerika yaitu William Draper Harkins pada tahun 1920
menduga adanya partikel lain dalam inti atom selain proton. Partikel
tersebut mempunyai massa yang hampir sama dengan massa proton tetapi
partikel tersebut tidak bermuatan. Selanjutnya Chadwick melakukan
eksperimen untuk mengetahui keberadaan partikel yang tidak bermuatan
atau bersifat netral.
Berikut ini gambar eksperimen yang dilakukan oleh Chadwick pada tahun 1932.
Dari
penembakan sinar α ke dalam pelat berilium akan menghasilkan suatu
radiasi yang tidak bermuatan. Apabila terdapat suatu materi padat dalam
hal ini menggunakan parafin ditempatkan sebagai penghalang, maka akan
mengakibatkan proton dari atom hidrogen akan terlempar keluar.
Partikel yang tidak bermuatan tersebut selanjutnya disebut dengan neutron, dengan massa yaitu 1,675 x 10-27 kg. Berikut ini massa dan muatan dari partikel subatom elektron, proton dan neutron.
Tabel I.1 Massa dan Muatan dari subatomik
Partikel
|
Lambang
|
Massa (kg)
|
Muatan
| |
Satuan
|
Coulomb
| |||
Elektron
|
e-
|
9,109 x 10 -31
|
-1
|
1,6 x 10-19
|
Proton
|
P
|
1,673 x 10 -27
|
+1
|
1,6 x 10-19
|
Neutron
|
N
|
1,675 x 10 -27
|
0
|
0
|